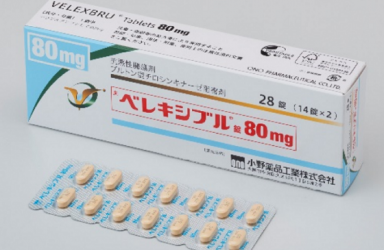
2020年08月21日 小野制药(Ono Pharmaceutical)宣布,BTK抑制剂Velexbru(tirabrutinib hydrochloride)在日本获批,用于治疗华氏巨球蛋白血症(WM)和淋巴浆细胞性淋巴瘤(LPL)。
此次WM和LPL适应症批准,基于一项多中心、开放标签、单臂II期研究(ONO4059-05)的结果。该研究评估了Velexbru在先前未经治疗的、或复发/难治性WM和LPL患者中的疗效和安全性。www.100pei.com
研究中,患者接受Velexbru 480mg空腹服药,每日口服一次,直至观察到疾病进展或不可接受的毒性。研究的主要终点是由独立审查委员会(IRC)评估确定的总缓解率(ORR),次要终点包括无进展生存期(PFS)和总生存期(OS)。
研究中,共27例患者接受了Velexbru治疗,18例为先前未经治疗的患者,9例为复发/难治性患者。结果显示:
- 未经治疗组的ORR为88.9%(16/18;95%CI:65.3-98.6)
- 复发/难治性治疗组的ORR为88.9%(8/9,95%CI:51.8-99.7)
次要终点方面,未经治疗组和复发/难治性治疗组在6个月时的无进展生存率和总生存率均为100%。
研究中,观察到的最常见的≥3级不良事件(AE)为中性粒细胞减少和淋巴细胞减少(各11.1%)和白细胞减少(7.4%)。
Velexbru(Tirabrutinib hydrochloride)80mg片剂,是一种高度选择性、口服布鲁顿酪氨酸激酶(BTK)抑制剂,在日本开发用于治疗B细胞肿瘤和自身免疫性疾病。
 扫一扫
扫一扫