2020年07月06日 默沙东(Merck & Co)在第23届国际艾滋病大会(AIDS 2020)虚拟会议上公布了IIb期临床试验(NCT03272347)的新分析数据。该研究在先前没有接受过抗逆转录病毒(ARV)药物治疗的HIV-1感染者中开展,正在评估其在研口服药Islatravir与Doravirine联合治疗的疗效和安全性。
- 第一个子分析进一步描述了3种剂量水平(0.25、0.75、2.25mg)islatravir联合doravirine(100mg)治疗48周的耐受性和安全性。
- 第二个子分析显示:启动islatravir和doravirine与拉米夫定(3TC)联合治疗的患者,在第48周维持抗病毒活性(HIV-1 RNA<50拷贝/毫升),协议定义的病毒学失败(PDVF)发生率较低,与3合1复方药Delstrigo(doravirine/3TC/TDF)相似。
- 48周分析数据加强了islatravir与doravirine联合用药作为一种二药方案(2DR)治疗HIV感染者的疗效和安全性。
目前,默沙东正在开展III期临床项目进一步评估。
IIb期研究子分析:islatravir与doravirine二药方案(2DR)48周安全性和方案定义的病毒学失败(PDVF)结果
在这项国际多中心临床试验中,先前未接受治疗(初治)HIV-1成人感染者,随机分配(1:1:1:1)到4个每日一次口服治疗组:islatravir 0.25 mg(n=29)、0.75 mg(n=30)、2.25 mg(n=31)联合doravirine(100 mg)和3TC(300 mg),Delstrigo(n=31)。www.100pei.com
在至少治疗24周后,3个islatravir治疗组中实现病毒学抑制(HIV-1 RNA<50拷贝/毫升)且不符合PDVF标准的受试者,转向2DR治疗,即:原先相同剂量的islatravir+doravirine(100mg),不含3TC。
在第48周,islatravir治疗组(7.8%)的药物相关不良事件发生率低于Delstrigo组(19.4%)。从第0周到第48周,所有islatravir组的药物相关不良事件发生率相似(0.25 mg–0.0%;0.75 mg–10.0%;2.25 mg–12.9%),islatravir的安全性无剂量依赖性差异。药物相关不良事件发生率,试验的第一个24周(0.25 mg–0.0%;0.75 mg–10.0%;2.25 mg–6.5%;Delstrigo–19.4%)高于第二个24周(0.25 mg–0.0%;0.75 mg–3.3%;2.25 mg–7.4%;Delstrigo–3.6%)。Delstrigo组报告的最常见不良事件(>10%的受试者报告)是腹泻(16.1%)、支气管炎(12.9%)、梅毒(12.9%)。在islatravir治疗组中,报告的最常见不良事件报告(>10%的受试者报告)为:0.25 mg(鼻窦炎、肢体疼痛、头痛,分别为10.3%、10.3%和13.8%);0.75 mg(腹泻、恶心、支气管炎、鼻咽炎、梅毒、维生素D缺乏,分别为13.3%、13.3%、13.3%、13.3%、10.0%、13.3%);2.25%mg(关节痛、头痛,分别为12.9%、12.9%)。大多数不良事件是轻微的,没有导致研究中止。2例islatravir治疗剂量组(均为2.25mg)因不良事件而停药。Delstrigo组1例患者因被认为与药物相关的严重不良事件而中止治疗。
在该研究中,PDVF被定义为病毒反弹(在研究过程中的任何时候,初始反应后HIV-1 RNA≥50拷贝/mL;或在研究期间的任何时候,在HIV-1 RNA较基线水平下降>1 log后确认HIV-1 RNA从最低HIV-1 RNA水平增加>1 log)或无反应(从第24周到第48周的任何时间HIV-1 RNA≥200拷贝/毫升,在第48周确认HIV-1 RNA≥50拷贝/毫升);PDVF必须在两周内通过额外的HIV-1 RNA测量来确认。
在第48周,PDVF的发生率很低,所有因PDVF而停药的受试者HIV-1 RNA水平低于200拷贝/毫升的临床显著水平。观察到的低水平病毒血症与其他先前未治疗患者的研究中检测到的水平相当。在第48周,0.25 mg、0.75 mg和2.25 mg islatravir组中,89.7%(26/29)、90.0%(27/30)和77.4%(24/31)的患者实现病毒学抑制(HIV-1 RNA<50拷贝/毫升),而Delstrigo组为83.9%(26/31)。6例患者符合PDVF标准:0.25 mg、0.75 mg islatravir组各有2例,2.25 mg islatravir组有1例无应答,Delstrigo组有1例病毒反弹。所有确认的HIV-1 RNA水平均<80拷贝/mL,且均不符合耐药性检测标准(>400 copies/mL)。尽管改用新的治疗方案,在停药后42天的评估中,6例患者中有3例(0.25 mg、0.75 mg islatravir组各1例,另1例来自Delstrigo组)仍有低水平病毒血症,HIV-1 RNA<200拷贝/毫升。www.100pei.com
III期DRIVE-SHIFT试验中的体重变化分析:
III期DRIVE-SHIFT研究是一项多中心、开放标签、随机、阳性对照、非劣效性III期研究,入组了670例接受一种抗逆转录病毒方案(基线方案)实现病毒学抑制至少6个月的HIV-1成人感染者,评估了由基线方案转向Delstrigo与继续基线方案的非劣效性。研究中,患者被随机分成2组:
- 1)立即转换组(ISG,n=447),在第0天转向Delstrigo治疗;
- 2)延迟转换组(DSG,n=223),在第24周后转向Delstrigo治疗。主要终点是病毒学抑制率,初步比较是Delstrigo ISG治疗组在第48周与基线方案DSG治疗组在第24周的病毒学抑制率,其次是比较Delstrigo ISG和基线方案DSG在第24周的病毒学抑制率。www.100pei.com
对该研究的事后分析新发现表明:
转向Delstrigo治疗的患者的体重变化,与在美国观察到的HIV阴性成人的平均变化相似。转向Delstrigo治疗2年后,ISG组患者体重增加1.4公斤(95%CI:0.8-1.9)、DSG组患者体重增加1.2公斤(95%CI:0.4-2.0)。
DRIVE-SHIFT研究的结果在IDWeek 2018会议上首次发布。www.100pei.com
在HIV感染者中,启动某些类型ARV疗法治疗与体重增加相关。来自DRIVE-SHIFT研究体重变化的事后分析表明,Delstrigo的体重变化与普通成年人群中观察到的平均年增重相当。
www.100pei.com
- Pifeltro(doravirine,DOR)多拉维林/多拉韦林 是每日口服一次的非核苷类逆转录酶抑制剂(NNRTI),适用于与其他ARV药物联合用药,用于治疗HIV-1成人感染者。
- Islatravir(MK-8591)是一种核苷类逆转录酶易位抑制剂(NRTTI)
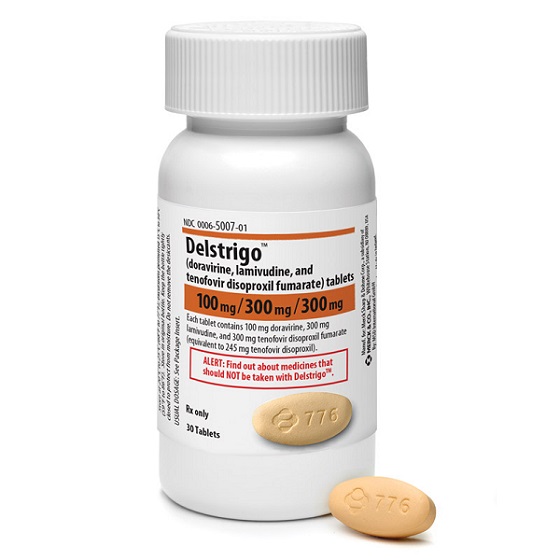
- Delstrigo(Doravirine/3TC/TDF)是每日1次3合1复方口服片,由固定剂量的抗病毒药物组成:
- 多拉韦林(DOR,100mg)
- 拉米夫定(3TC,300mg)
- 富马酸替诺福韦二吡呋酯(TDF,300mg)
 扫一扫
扫一扫