2023年02月21日(新泽西州富兰克林湖)医疗技术公司BD(Becton, Dickinson and Company)宣布美国食品药品监督管理局(FDA)批准其BD Onclarity™ HPV 检测与 ThinPrep® 巴氏试验一起使用。
BD SurePath™ 液基巴氏试验小瓶和 Hologic ThinPrep® 巴氏试验 PreservCyt® 溶液小瓶是美国实验室使用的两种最常用的巴氏试验小瓶。包含 ThinPrep® 巴氏试验可提高 BD 人乳头瘤病毒 (HPV) 检测的优势,该检测是 FDA 批准的唯一1种可单独检测大量 HPV 类型的检测方法,尤其是 HPV31,一种特定的是导致宫颈癌的高风险 HPV 类型。HPV31 的个体鉴定有助于更好地确定宫颈癌前病变的风险,这可能导致医疗保健提供者做出不同的临床决策,而不是在多个基因型一起报告时评估风险。
这一重要的里程碑支持 BD 的战略,即通过扩大安装基础并为女性健康提供额外的测试解决方案来渗透庞大且不断增长的分子诊断市场。
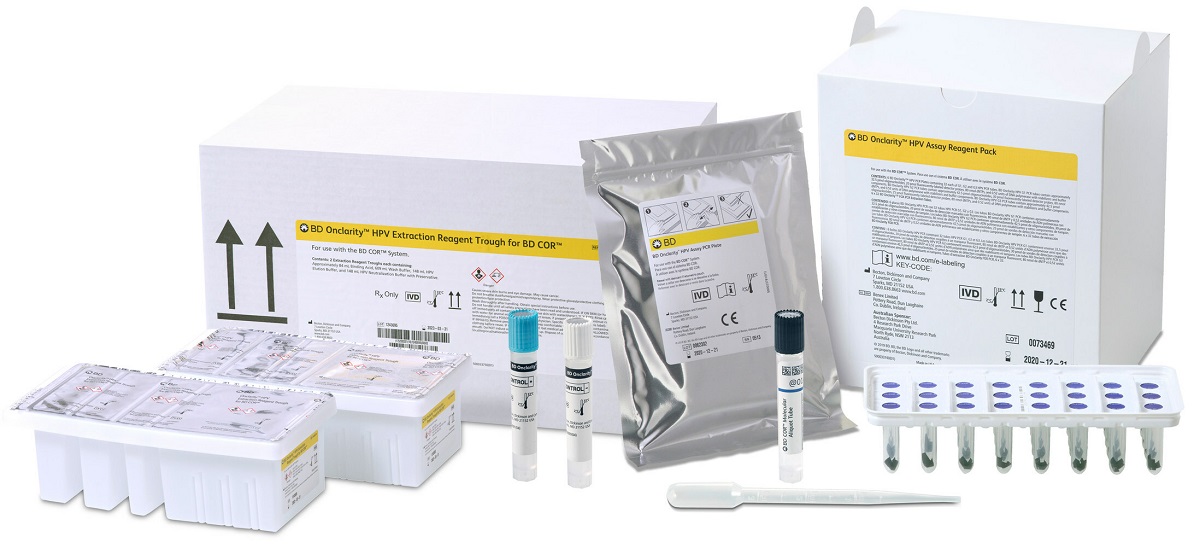
BD Onclarity™ HPV 检测可在单次分析中检测并识别 14 种高危人乳头瘤病毒 (HPV) 类型。该测定报告的基因型超出 HPV 16、18 和 45 型,包括 31、51、52、33/58、35/39/68 和 56/59/66 型,使 BD Onclarity™ HPV 测定成为唯一的 FDA-经批准的检测方法可以单独识别和报告这些基因型结果。BD Onclarity™ HPV 检测已获得 FDA 批准用于接种疫苗的女性。随着先前接种疫苗的亚群年龄的增长,筛查人群将逐渐包括 HPV 16 和 18 流行率降低的女性,从而增加在接种疫苗和未接种疫苗的女性混合人群中扩展基因型报告的价值。
由Cosette Wheeler博士与新墨西哥 HPV 和 Pap Registry进行的同类最大的真实世界证据研究之一实现了使用 PreservCyt® 培养基对 BD Onclarity™ HPV 检测进行临床验证的证据生成,包括随机抽样的 19,879 名女性保存样本,这些样本在常规临床实践中接受了机会性宫颈筛查和随访,临床结果已知。
ThinPrep® Pap Test with BD Onclarity™ HPV Assay 可用于 BD COR™ 或 BD Viper™ LT 仪器平台,无需更换当前的细胞学设备。BD COR™ 系统提供集成和自动化的工作流程,旨在节省高通量实验室的时间,BD Onclarity™ HPV 检测的扩展声明允许中低通量实验室利用台式 BD Viper™ LT仪器来增强他们的 HPV 测试产品。
| 信息 | 来源 |
| BD Onclarity™ HPV Assay Receives FDA Approval for Use with Both BD SurePath™ Liquid-based Pap Test and Hologic ThinPrep® Pap Test | https://www.prnewswire.com/news-releases/bd-onclarity-hpv-assay-receives-fda-approval-for-use-with-both-bd-surepath-liquid-based-pap-test-and-hologic-thinprep-pap-test-301750381.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫