2022年06月13日(爱尔兰沃特福德) 专注治疗罕见和被忽视的热带病(包括严重疟疾)的AMIVAS Ireland Ltd.宣布,英国药品和保健品监管机构 (MHRA) 已授权该公司将其商业化其主导产品Artesunate Amivas (Artesunate)青蒿琥酯在英国用于成人和儿童重症疟疾的初始治疗。
该批准是基于人用医药产品委员会(CHMP) 最近提出的授予此类授权的建议。
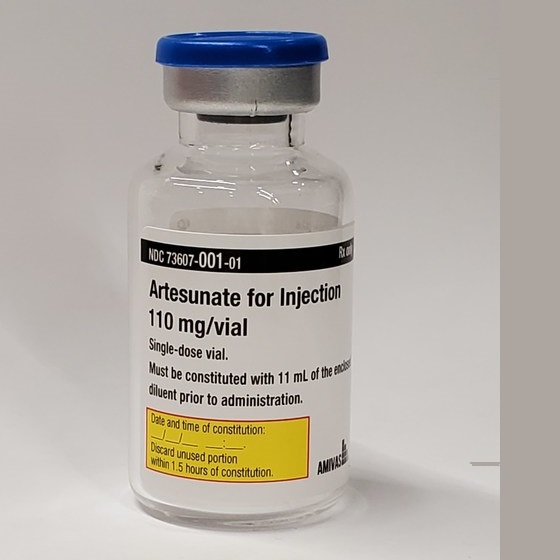
Artesunate Amivas 将于 2023 年第一季度以 110 mg 粉末和溶剂形式提供,用于注射批次溶液,并按照 EMA/MHRA 规范制造。 随着 AMIVAS 提高产量并建立分销渠道以满足英国每年出现严重疟疾患者的治疗需求,Artesunate Amivas 将在未来几个月开始在英国推出。大多数病例是在前往非洲的游客和部署到疟疾流行地区的军事人员中诊断出来的。未经治疗的严重疟疾(尤其是脑型疟疾)的死亡率接近 100%。
静脉注射青蒿琥酯已被证明可以提高流行地区和美国重症疟疾患者的生存率,对高寄生虫血症患者尤其有益。在美国开发青蒿琥酯是在美国陆军医学研究与发展司令部 (USAMRDC) 下进行的。自 2007 年以来,在 USAMRDC 内,沃尔特里德陆军研究所和美国陆军医疗物资开发活动 (USAMMDA) 的联合协作工作为疾病控制和预防中心 (CDC) 提供了持续的静脉注射青蒿琥酯。 USAMMDA 建立了合作研究与 AMIVAS 达成开发协议,以使青蒿琥酯生产现代化并在美国食品和药物管理局注册产品。
MHRA 对 Artesunate Amivas 的授权现在满足了一项关键战略目标,即通过批准的严重疟疾医疗对策来支持美国的北约盟国。
临床研究:IV 青蒿琥酯的安全性和有效性在三项试验中进行了研究,包括东南亚奎宁青蒿琥酯疟疾试验 (SEAQUAMAT) 和非洲奎宁青蒿琥酯疟疾试验 (AQUAMAT)。这两项研究共检查了 6,886 名患者,包括成人、儿童和孕妇。与 SEAQUMAT 和 AQUAMAT 研究中的注射标准护理药物相比,IV Artesunate 分别降低了 34.7% 和 22.5% 的死亡率。数据也在2007 年1 月至2010 年12 月期间收集根据 CDC 扩大准入协议,对 102 名美国重症或复杂疟疾患者进行静脉注射青蒿琥酯。92 名患者在 0、12、24 和 48 小时接受了至少一次药物给药。这些美国患者包括成人、儿童、孕妇和老年人。大多数是黑人或非裔美国人,25% 是白人,9% 是亚洲人。七名患者死于严重疟疾并发症(死亡率为 6.9%)。参与 CDC 研究的患者数据分析的主要资金来源是美国陆军部外科医生办公室。虽然没有积极招募任何服务人员参与 IV 青蒿琥酯的任何临床试验,但根据 CDC 协议为几名服务人员提供了紧急治疗。
| 信息 | 来源 |
| AMIVAS Ireland Ltd. Receives Authorisation from the Medicines & Healthcare Products Regulatory Agency (MHRA) to Market Artesunate Amivas (artesunate) in U.K. for Initial Treatment of Severe Malaria | https://www.prnewswire.com/news-releases/amivas-ireland-ltd-receives-authorisation-from-the-medicines–healthcare-products-regulatory-agency-mhra-to-market-artesunate-amivas-artesunate-in-uk-for-initial-treatment-of-severe-malaria-301566099.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫 




