2022年05月13日(新泽西州泽西市),日本田边三菱制药美国(Mitsubishi Tanabe Pharma America,MTPA)宣布,美国FDA已批准Radicava ORS(edaravone)口服依达拉奉上市治疗肌萎缩侧索硬化(ALS)。
RADICAVA ORS 依达拉奉口服液提供与 RADICAVA ®( edaravone)依达拉奉注射液相同的功效。Radicava ORS在一项关键性临床试验中,与FDA批准的静脉输注配方相比,在延缓身体机能衰退方面表现出相同的效力。这款口服配方为ALS患者提供了一种灵活的用药方式,可以使用口服或者用喂食管给药,并且不需剂量调整。FDA的批准得到多项研究的支持,包括评估137名ALS患者的关键性3期临床研究。试验结果显示,Radicava ORS在治疗24周后,与安慰剂相比,将患者身体功能衰退减缓33%。
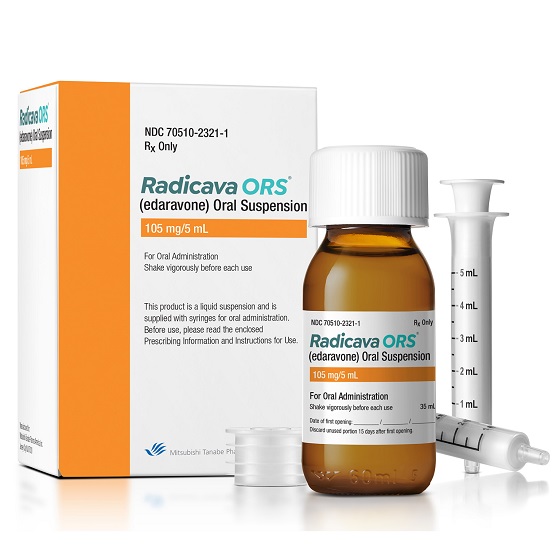
RADICAVA ORS 专为 ALS 患者配制,提供灵活的给药选择(口服或通过饲管),小剂量 5 mL、便携式瓶、口服给药注射器,患者服用前无需冷藏或重新配制. 在医疗保健提供者 (HCP) 的适当指导下,RADICAVA ORS 可能只需几分钟即可在治疗日给药。 RADICAVA ORS 应在隔夜禁食后的早晨服用。
依达拉奉在 ALS 中的综合临床开发计划已跨越十多年,其中包括针对静脉注射和口服制剂的多项临床试验。FDA 对 RADICAVA ORS 的批准得到了几项研究的支持,其中包括来自关键 3 期临床试验 (MCI186-19) 的数据,该试验评估了 137 名 ALS 患者,这些患者显示 RADICAVA 治疗可将身体功能的丧失减慢 33%(约三分之一)与 24 周时的安慰剂相比,由 ALS 功能评定量表修订版 (ALSFRS-R) 测量,这是一种经过验证的用于监测患者疾病进展的评定工具。此外,还进行了七项 1 期临床药理学研究,以检查 RADICAVA ORS 在有和没有经皮内窥镜胃造口术 (PEG) 管的健康个体和 ALS 患者中的药代动力学、安全性、药物间相互作用、剂量、生物利用度和生物等效性/鼻胃(NG)管,以及一项为期 24 周的全球3期试验, 证明了 185 名 ALS 患者治疗的安全性和耐受性。最后,正在进行一项 3 期研究,评估 RADICAVA ORS 长达 96 周的长期安全性和耐受性。
超过 10% 的 RADICAVA 治疗患者发生的最常见不良事件是瘀伤(挫伤)、行走问题(步态障碍)和头痛。服用 RADICAVA ORS 的患者中有 7.6% 观察到疲劳。RADICAVA 和 RADICAVA ORS 禁用于对依达拉奉或本品的任何非活性成分有过敏史的患者。在用 RADICAVA 治疗的患者中报告了超敏反应和过敏反应。
依达拉奉(edaravone)的静脉注射剂型在2017年获得美国FDA的批准上市。它的作用机制仍未完全获得澄清,被认为是通过降低氧化应激来延缓疾病进展。Radicava ORS是针对ALS患者制造的口服配方,它是体积为5 mL的液体配方,可以使用注射器口服或者输入到喂食管中,不需要冷藏也不需要在使用前溶解。在接受适当指导后,医务人员只需几分钟就可以完成给药。
肌萎缩侧索硬化(ALS) 是由于大脑和脊柱中的运动神经元死亡,导致肌肉功能丧失的神经退行性疾病。患者确诊后平均预期寿命为2~5年,目前治疗选择缺乏。这是一种目前没有治愈方法,进展迅速的神经退行性疾病。
| 信息 | 来源 |
| Mitsubishi Tanabe Pharma America Announces FDA Approval of RADICAVA ORS® (edaravone) for the Treatment of ALS | https://www.prnewswire.com/news-releases/mitsubishi-tanabe-pharma-america-announces-fda-approval-of-radicava-ors-edaravone-for-the-treatment-of-als-301546937.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫 




