2021年11月29日(美国印第安纳州西拉斐特)On Target Laboratories公司宣布,美国FDA已经批准其靶向荧光成像剂Cytalux(pafolacianine)注射液 用于成年卵巢癌患者,作为术中识别恶性病变组织的辅助手段。
FDA 对 CYTALUX 的批准是基于 3 期注册试验的数据,该试验表明,在 27% 的患者中,CYTALUX 发现了可能会留下的额外病变(N=134,95% CI [0.196, 0.352])。在对化疗后接受手术(称为间隔减瘤手术)的确诊卵巢癌患者进行的亚组分析中,发生率为 40%(N=58,95% CI [0.270, 0.534])。该亚组分析使用了比主要终点更小的分析集,并且没有针对误差进行调整,因此结果可能被夸大了,应谨慎解释。
近红外荧光 CYTALUX 检测中心病理证实的卵巢癌病变的患者水平假阳性率为 20.2%,置信区间为 95%(13.7%、28.0%)。
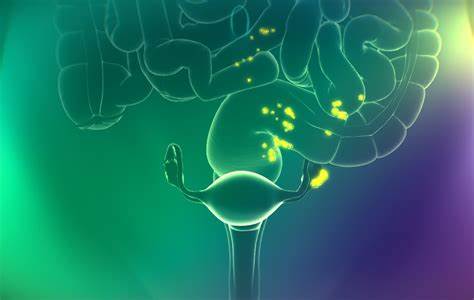
Cytalux(Pafolacianine)荧光染料,研发代码OTL38,是一款与叶酸受体结合的荧光成像剂,叶酸受体在多数上皮卵巢癌中过度表达。
荧光引导手术:Cytalux在进行手术前1小时内通过标准静脉输注给药,在红外光的照射下可以照亮肿瘤。
细胞减灭手术(cytoreductive surgery)是治疗卵巢癌的常见手段,然而研究发现,即使接受接受最佳细胞减灭手术的患者中,40%的患者在手术30天之后的成像检测中发现可以测量的病灶。

| 信息 | 来源 |
| On Target Laboratories Announces FDA Approval of CYTALUX™ (pafolacianine) injection for Identification of Ovarian Cancer During Surgery. | https://www.prnewswire.com/news-releases/on-target-laboratories-announces-fda-approval-of-cytalux-pafolacianine-injection-for-identification-of-ovarian-cancer-during-surgery-301433036.html |
| 免责声明 | 本资料仅作信息分享参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫 



